
自今年5月29日首次遞表港交所以來,贛州和美藥業(yè)股份有限公司(簡稱“贛州和美藥業(yè)”)尚未通過聆訊。該公司申請在香港聯(lián)交所主板上市,擬募資用于旗下2個核心產(chǎn)品的研發(fā)和商業(yè)化及其他管線產(chǎn)品的研發(fā)。
招股書顯示,贛州和美藥業(yè)的經(jīng)營歷史最早可追溯至2002年,其創(chuàng)始人張和勝創(chuàng)立了該公司的研發(fā)實體和美生物技術(shù),并于2009年開始聚焦核心產(chǎn)品Mufemilast的臨床前研究。
贛州和美藥業(yè)針對自身免疫性疾病和腫瘤進(jìn)行小分子藥物開發(fā),截至今年5月21日已擁有含7個小分子候選藥物的研發(fā)管線。其中,Mufemilast是該公司最早研發(fā)且研發(fā)進(jìn)展最快、開發(fā)適應(yīng)證最多的核心產(chǎn)品。
招股書顯示,贛州和美藥業(yè)于2012年就Mufemilast提交臨床試驗申請,并在此后針對Mufemilast的8個適應(yīng)證開展臨床試驗。2024年3月,Mufemilast完成用于治療銀屑病(Ps)的國內(nèi)臨床Ⅲ期試驗后,贛州和美藥業(yè)向國家藥監(jiān)局提交Mufemilast在銀屑病適應(yīng)證下的新藥上市申請(簡稱“NDA”)并獲優(yōu)先審評資格。
這意味著,在持續(xù)研發(fā)逾22年之后,贛州和美藥業(yè)或迎來其首個獲批產(chǎn)品。其累計耗時15年才完成Mufemilast的研發(fā),其中光臨床試驗階段(2012—2024年)就占了13年。
不過,即便尚未獲批上市,Mufemilast所面臨的競爭環(huán)境已趨激烈。招股書顯示,我國已上市且已進(jìn)入醫(yī)保目錄的、用于治療銀屑病的小分子靶向藥共計有5個,其中,安進(jìn)公司(AMGN.O)的apremilast(中文譯名:阿普司特/阿普米司特)與Mufemilast一樣靶向PDE4。此外,Mufemilast還有36個臨床階段的在研競品,其中6個處于臨床Ⅲ期試驗。
招股書未披露的是,2024年12月,上海陽光醫(yī)藥采購網(wǎng)公布的第十批全國藥品集采中選結(jié)果顯示,阿普米司特進(jìn)入該批次集采的仿制藥企業(yè)有8家。
6月16日、8月22日,就Mufemilast上市審批進(jìn)展、Mufemilast商業(yè)化進(jìn)展、研發(fā)資金可持續(xù)性等相關(guān)問題,時代商業(yè)研究院向贛州和美藥業(yè)發(fā)郵件并嘗試致電詢問。截至發(fā)稿,該公司尚未回復(fù)相關(guān)問題。
成立至今逾22年尚未有產(chǎn)品獲批
作為一家生物制藥公司,贛州和美藥業(yè)致力于發(fā)現(xiàn)和開發(fā)針對自身免疫性疾病和腫瘤的小分子藥物。招股書顯示,截至2025年5月21日,該公司已經(jīng)開發(fā)出由7個候選藥物組成的在研產(chǎn)品管線。
從研發(fā)進(jìn)度看,贛州和美藥業(yè)的2個核心產(chǎn)品中,一個已提交NDA申請且尚未獲批上市,一個正在臨床Ⅲ期試驗;3個關(guān)鍵產(chǎn)品正在臨床Ⅰ、Ⅱ期試驗中;另有2個在研產(chǎn)品尚處于臨床前研究。
不過,贛州和美藥業(yè)的經(jīng)營歷史最早可追溯至2002年。是年,該公司創(chuàng)始人張和勝成立了研發(fā)實體——和美生物技術(shù),開啟了贛州和美藥業(yè)的創(chuàng)新藥研發(fā)之路。
2009年,贛州和美藥業(yè)開始第一個研發(fā)產(chǎn)品Mufemilast的臨床前研究,并于2012年就Mufemilast提交臨床試驗(IND)批準(zhǔn)申請,并于2015年后就Mufemilast治療銀屑病(Ps)、白塞病(BD)、強(qiáng)直性脊柱炎(AS)等8種自身免疫性適應(yīng)證開展臨床試驗。
2024年,贛州和美藥業(yè)完成Mufemilast用于治療銀屑病的臨床Ⅲ期試驗后,向國家藥監(jiān)局遞交了NDA申請并獲得優(yōu)先審批資格。這意味著,作為該公司最早研發(fā)且研發(fā)投入最大的核心產(chǎn)品,Mufemilast或是該公司研發(fā)進(jìn)展最快、有望實現(xiàn)首個獲批上市的產(chǎn)品。
自2002年至今,專注于新藥研發(fā)逾22年之久,Mufemilast若能實現(xiàn)首個獲批上市,無疑意味著贛州和美藥業(yè)的經(jīng)營發(fā)展邁入了新的階段。要知道,從2012年提交臨床試驗申請到2024年提交NDA申請,Mufemilast光臨床試驗階段就耗費了12年之久。
由于無上市產(chǎn)品,自成立至今,贛州和美藥業(yè)主要以融資支撐其研發(fā)活動。招股書顯示,僅2021—2024年,該公司就完成了6輪融資,累計獲得3258.62萬美元和人民幣10.49億元,若按1美元兌7.18元人民幣折算,該公司累計融資12.83億元。
招股書還顯示,贛州和美藥業(yè)于2024年12月最新完成E輪融資所對應(yīng)的投后估值為39億元,較該公司2021年11月A輪融資的投后估值2億元,增長18.5倍。
2023—2024年,贛州和美藥業(yè)分別虧損1.56億元、1.23億元,截至2024年末該公司累計虧損7.07億元。
核心產(chǎn)品未上市已面臨紅海競爭
作為有望首個獲批上市的核心產(chǎn)品,Mufemilast的商業(yè)化前景仍存在諸多挑戰(zhàn)。
招股書顯示,Mufemilast是一種新型小分子磷酸二酯酶4B(PDE4B)蛋白表達(dá)阻斷劑和磷酸二酯酶4(PDE4)抑制劑,具有廣泛的自身免疫性疾病治療潛力。據(jù)弗若斯特沙利文的報告,因為Mufemilast可以同時阻斷PDE4B蛋白的表達(dá),亦可抑制PDE4的活性,Mufemilast可能是一種具有雙重作用機(jī)制的全球同類首創(chuàng)藥物,也是唯一可直接用于有潛伏性結(jié)核感染的銀屑病患者的藥物。
但是上述理論治療價值能否在臨床治療上得到驗證,并進(jìn)一步獲得醫(yī)生和患者的廣泛接受,仍有待觀察。
招股書則顯示,截至2025年5月21日,我國已上市且已進(jìn)入醫(yī)保目錄的、用于治療銀屑病的小分子靶向藥共計有5種,其中安進(jìn)公司生產(chǎn)的apremilast(中文譯名:阿普司特/阿普米司特)跟Mufemilast一樣靶向PDE4。作為原研藥,安進(jìn)公司的阿普米司特已于2021年進(jìn)入國家醫(yī)保目錄。
此外,阿普米司特在國內(nèi)已有多家仿制藥生產(chǎn)企業(yè),且已于2024年被納入國家第十批藥品集采。
2024年12月,上海陽光醫(yī)藥采購網(wǎng)公布的第十批全國藥品集采中選結(jié)果顯示,有8家生產(chǎn)阿普米司特仿制藥的制藥企業(yè)在本次集采中中標(biāo)。
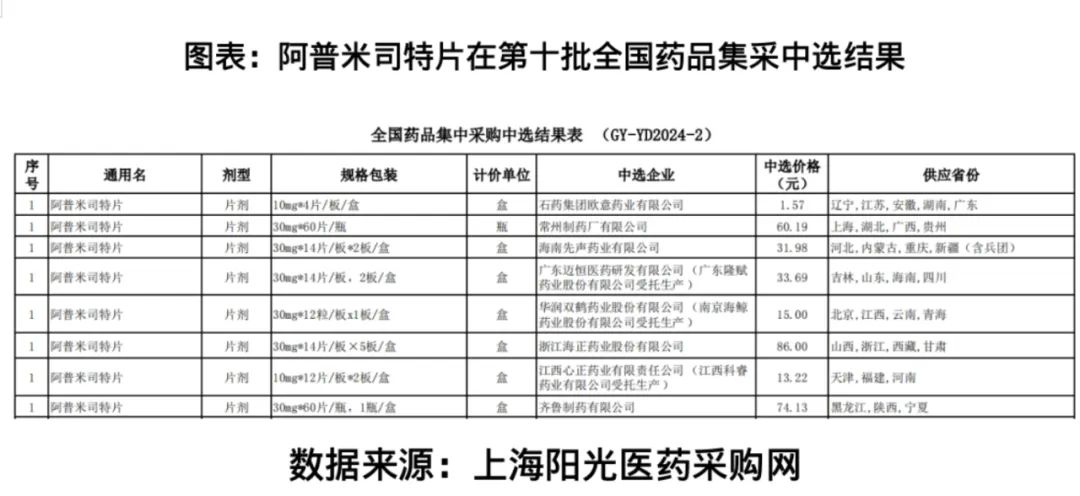
招股書還顯示,除了已上市競品,Mufemilast亦面臨多個在研競品。截至2025年5月21日,我國用于治療銀屑病的小分子靶向藥在研管線藥物中,進(jìn)入臨床階段的共計有36個,其中6個處于臨床Ⅲ期試驗階段。(時代商業(yè)研究院 雷小艷)

 京公網(wǎng)安備 11010802028547號
京公網(wǎng)安備 11010802028547號